Il cancro rappresenta una delle principali sfide sanitarie a livello globale e nazionale, con un impatto significativo sulla salute pubblica, sull’economia e sulla società. In Italia, il rapporto “I Numeri del Cancro 2024” offre un’analisi dettagliata e aggiornata su incidenza, mortalità, prevalenza, screening, fattori di rischio e progressi terapeutici. Questo documento non solo fotografa lo stato attuale della malattia, ma evidenzia anche opportunità per migliorare prevenzione, diagnosi precoce e trattamento, contribuendo a una pianificazione sanitaria più mirata ed efficace.
Nel 2024, si stimano circa 390.000 nuove diagnosi di tumore maligno in Italia. Tra le neoplasie più comuni, nei maschi prevalgono tumori alla prostata, polmoni e colon-retto, mentre nelle femmine il tumore alla mammella rimane il più frequente, seguito da colon-retto e polmoni.
Negli ultimi anni, si è registrata una diminuzione significativa della mortalità oncologica, in particolare nella fascia di età 20-49 anni, grazie ai progressi terapeutici e alla diffusione degli screening. Tuttavia, persistono importanti disuguaglianze geografiche e socioeconomiche nell’accesso ai programmi di prevenzione e diagnosi precoce.
L’Oncologia in Italia – Dati, Rischi e Screening
Il cancro rappresenta una delle principali cause di mortalità in Italia, ma gli ultimi dati mostrano segnali incoraggianti grazie a prevenzione, diagnosi precoce e innovazioni terapeutiche. Secondo il rapporto “I Numeri del Cancro in Italia 2024”, si stimano circa 390.000 nuovi casi di tumore maligno diagnosticati nel corso dell’anno, con una riduzione della mortalità osservata negli ultimi decenni, specialmente nei giovani adulti.
Incidenza e Prevalenza
Nuovi casi stimati per il 2024: 214.000 negli uomini e 175.000 nelle donne.
Tumori più comuni:
– Uomini: Prostata (40.190 casi), Polmone (31.900 casi), Colon-retto (27.500 casi), Vescica (25.230 casi).
– Donne: Mammella (53.060 casi), Colon-retto (21.230 casi), Polmone (12.940 casi), Endometrio (8.650 casi), Tiroide (8.320 casi).
Riduzione della Mortalità
Tra il 2006 e il 2021, i tassi di mortalità standardizzati per età sono diminuiti del 28% negli uomini e del 21,4% nelle donne di età compresa tra 20 e 49 anni. Questa riduzione è attribuibile al miglioramento delle cure e all’adesione ai programmi di screening organizzati.
Popolazione Vivente Dopo Diagnosi
Oggi, circa 3,7 milioni di italiani vivono dopo una diagnosi di tumore, di cui:
– Uomini: 1,6 milioni.
– Donne: 2 milioni, con il tumore della mammella che rappresenta quasi la metà delle diagnosi.
Fattori di Rischio: Lo Stile di Vita Fa la Differenza
Tabacco e Alcol
– Fumatori: 24% degli italiani tra 18-69 anni, con tassi più alti tra uomini (28%) e giovani.
– Consumo a rischio di alcol: 18% della popolazione adulta, associato a malattie epatiche e tumori.
Sedentarietà e Sovrappeso
– Sedentarietà: 28% degli adulti non pratica attività fisica, con picchi nel Sud Italia (40%).
– Eccesso ponderale: Il 43% degli italiani è in sovrappeso o obeso.
Dieta
Solo il 7% consuma le cinque porzioni giornaliere di frutta e verdura raccomandate, un’abitudine che potrebbe ridurre il rischio di tumore fino al 30%.
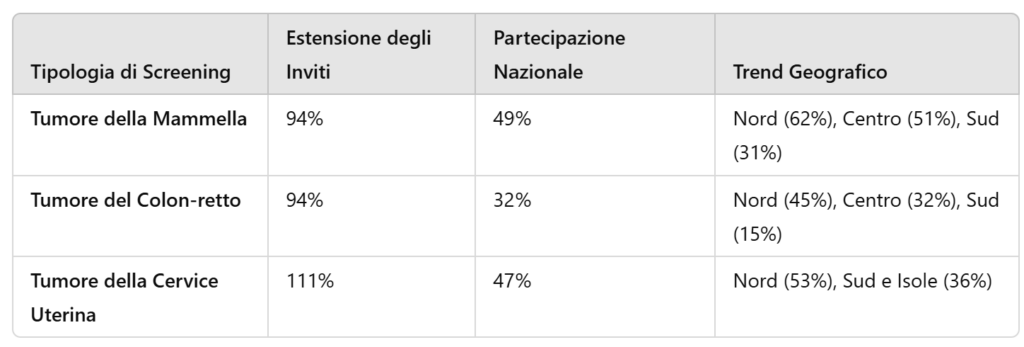
Screening Oncologici: Prevenzione e Diagnosi Precoce
Gli screening organizzati sono strumenti fondamentali per ridurre la mortalità oncologica. Nel 2023, le coperture variano tra le diverse tipologie di tumori:
Considerazioni Generali
Nonostante i progressi, permangono aree critiche:
Accesso Disomogeneo: Disparità tra Nord e Sud nell’adesione agli screening.
Stili di Vita: Necessità di interventi educativi per promuovere una dieta equilibrata e l’attività fisica.
Screening Specifici: Espansione necessaria per i tumori meno coperti, come il tumore al polmone.
I dati epidemiologici, i fattori di rischio e i programmi di screening delineano un quadro complesso ma ricco di opportunità per migliorare la prevenzione e la gestione del cancro in Italia. Promuovere la consapevolezza e implementare strategie mirate rappresentano passi fondamentali verso una sanità più equa ed efficace.
La Sopravvivenza media ai Tumori per singole sedi:
Vie aerodigestive superiori: FARINGE, LARINGE e CAVO ORALE

I tumori delle vie aerodigestive superiori (faringe, laringe e cavo orale), benché re-lativamente poco frequenti, rappresentano un problema clinico e sociale maggiore per la delicatezza delle funzioni che possono compromettere. La prevenzione primaria è possibile grazie alla conoscenza dei fattori di rischio (fumo, alcol, infezione da papillo-ma virus HPV), ma ancora non sufficientemente diffusa.
La prevenzione terziaria utilizza chirurgia, radioterapia e terapie mediche (chemioterapia, immunoterapia, terapie target) nei casi avanzati. L’avanzamento nelle tecniche chirurgiche, come la chirurgia robotica, e nelle radioterapie ha migliorato la qualità di vita dei pazienti riducendo le complicazioni post-trattamento.
La prognosi dipende dallo stadio della malattia: senza coinvolgimento linfonodale, la sopravvivenza a 5 anni supera l’80% con chirurgia, radioterapia o entrambe. Il coinvolgimento linfonodale abbassa la sopravvivenza al 50%, scendendo al 10-20% nei casi gravi. Spesso, la chemioterapia si associa alla radioterapia post-operatoria o nei trattamenti non operabili.
Le recidive possono, sebbene raramente, essere nuovamente trattate chirurgicamente o con radioterapia, con buoni risultati soprattutto nella rimozione di metastasi polmonari isolate. È essenziale il monitoraggio clinico per 3–5 anni, ma spesso il trattamento medico è l’unica opzione.
La chemioterapia nei casi con espressione della proteina PD-L1 (circa 85%) combina cisplatino, fluorouracile e immunoterapia, bloccando l’effetto della proteina PD-L1. Nei tumori con alta espressione di PD-L1, l’immunoterapia può bastare, evitando la chemioterapia.
L’immunoterapia, sola o con chemioterapia, aumenta la sopravvivenza a 15 mesi, con un plateau di lungo sopravviventi del 20-30%. La scelta tra immunoterapia sola o combinata dipende dalle condizioni cliniche e dal tumore. Nei pazienti senza PD-L1, solo la chemioterapia è efficace, con sopravvivenza mediana di 10 mesi.
L’immunoterapia è attiva anche come seconda linea, dopo chemioterapia, mantenendo una quota di sopravviventi oltre i tre anni. Non ci sono dati sul ruolo dell’immunoterapia dopo trattamenti precedenti.
La tossicità dell’immunoterapia è minore rispetto alla chemioterapia, ma è fondamentale identificare presto eventuali reazioni autoimmuni per evitare complicazioni.
Ricerche sono in corso per ottimizzare farmaci immunoterapici e valutare nuovi trattamenti per tumori della testa e collo. Le terapie mirate a mutazioni geniche sono promettenti, ma i farmaci specifici sono disponibili solo per una piccola parte di mutazioni, come H-RAS (3%) e NTRK (0,5%). La ricerca in questo campo rimane promettente.
Tumore dell’ ESOFAGO

L’elevata mortalità del tumore dell’esofago, seppur raro, richiede maggiori sforzi di prevenzione primaria, focalizzandosi su fumo, alcool, obesità e reflusso gastroesofageo. Le variazioni geografiche nella distribuzione di carcinoma a cellule squamose (SCC) e adenocarcinoma (AC) si devono a diversi fattori: alcool e fumo per SCC; obesità e reflusso per AC, spiegando l’aumento di AC in Occidente. L’aggressività di entrambi i tipi impone nuove strategie terapeutiche.
La gestione del carcinoma esofageo richiede un approccio multidisciplinare con specialisti dedicati (chirurgo oncologico, oncologo, radioterapista, endoscopista, anatomopatologo, nutrizionista) per migliorare il controllo della malattia e le possibilità di guarigione. Uno staging accurato include endoscopia, ecografia linfonodale, EUS, TC total-body, PET/TC e broncoscopia per neoplasie toraciche superiori, oltre alla valutazione nutrizionale del paziente per fornire supporto adeguato.
Il trattamento varia tra SCC e AC, soprattutto in stadi avanzati. L’endoscopia è il primo trattamento per tumori superficiali (Tis, T1), mentre l’esofagectomia è indicata per tumori più invasivi. Nei pazienti non idonei alla chirurgia, viene preferito il chemioradioterapico. La chemioradioterapia è utilizzata negli stadi localmente avanzati per SCC e AC, con protocolli chemioterapici specifici. Nei pazienti con tumori squamosi avanzati, la chemioradioterapia definitiva è appropriata, riservando la chirurgia come opzione di salvataggio.
Per l’adenocarcinoma in stadi avanzati, il trattamento perioperatorio FLOT è preferito, con una migliore sopravvivenza rispetto ad altre terapie. Nei tumori non resecabili (cT4b), la chemioradioterapia esclusiva è indicata per adenocarcinoma, mentre nei tumori squamosi può essere necessaria una tracheobroncoscopia per valutare l’invasione tracheobronchiale. La presenza di fistole richiede l’uso di stent prima di ulteriori trattamenti.
Recenti progressi includono terapie target e farmaci immunoterapici per tumori esofagei avanzati. L’immunoterapia (nivolumab, pembrolizumab) è utilizzata in prima linea con chemioterapia per tumori squamosi con espressione di PD-L1 e in seconda linea per recidive. Per adenocarcinomi avanzati, si impiegano pembrolizumab o nivolumab con chemioterapia per pazienti con determinati livelli di PD-L1.
Tumore dello Stomaco
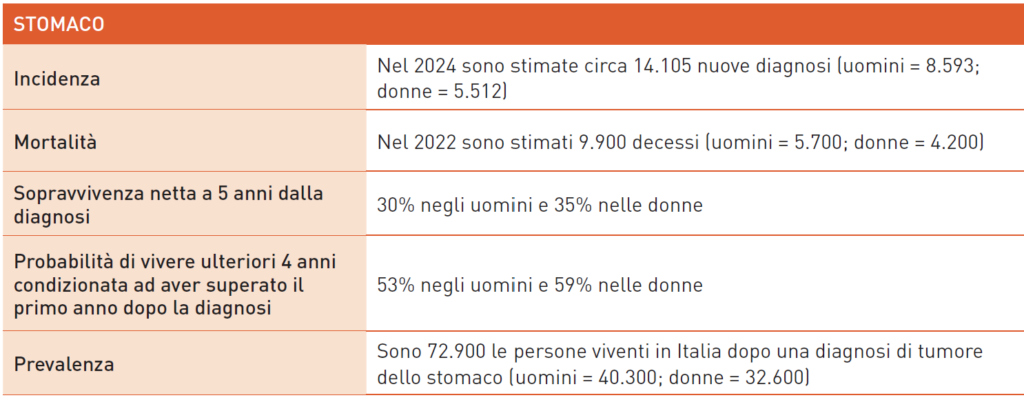
Il carcinoma gastrico è una neoplasia aggressiva con prognosi sfavorevole, caratterizzata da un elevato tasso di recidive e frequente presentazione avanzata. La sopravvivenza a 5 anni in Europa è del 25%, mentre in Italia è più alta (32%). La chirurgia, con gastrectomia e linfoadenectomia D2, è il trattamento principale per i tumori dello stomaco. Tuttavia, l’approccio multimodale con chemioterapia perioperatoria, come il regime FLOT, è in uso per ridurre le recidive. Nella malattia avanzata, la chemioterapia con un platino e 5-fluorouracile è standard, ma l’immunoterapia con nivolumab e pembrolizumab offre i risultati migliori, migliorando la sopravvivenza nei pazienti con PD-L1 CPS ≥ 5. Il trastuzumab è efficace nei tumori HER2 positivi, migliorando la sopravvivenza rispetto alla sola chemioterapia. Circa il 40-50% dei pazienti può ricevere una seconda linea di trattamento, con il ramucirumab che ha mostrato efficacia in monoterapia o combinato con paclitaxel. Il pembrolizumab è raccomandato per tumori MSI-H, con una sopravvivenza a tre anni del 34.5%. Per i tumori HER2 positivi in progressione, il trastuzumab deruxtecan ha prodotto risposte significative nei pazienti pretrattati. La trifluridina/tipiracile migliora la sopravvivenza nei pazienti post-seconda linea con PS 0-1. Nuovi agenti come zolbetuximab e bemarituzumab mostrano promesse. Nonostante le sfide, negli ultimi anni sono migliorate le strategie terapeutiche per il carcinoma gastrico, grazie a nuovi farmaci biomolecolari e una strategia di “continuum of care”. L’ottimizzazione delle terapie di supporto, soprattutto nutrizionali, ha migliorato la qualità della vita dei pazienti, permettendo più linee di trattamento.
Tumoti Colon-retto
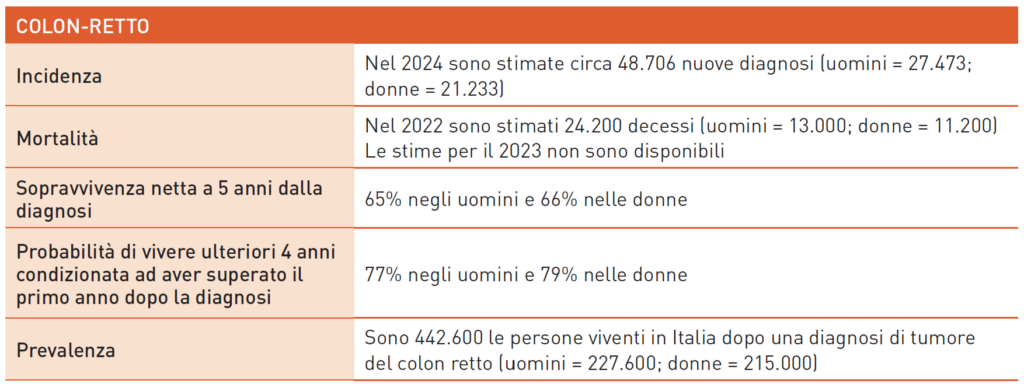
I tumori del colon-retto sono legati a stili di vita e familiarità. Fattori di rischio includono carni rosse, insaccati, farine e zuccheri raffinati, sovrappeso, inattività fisica, fumo e alcool. Fattori protettivi comprendono frutta, verdura, carboidrati non raffinati, vitamina D, calcio e antinfiammatori non steroidei. Malattia di Crohn e rettocolite ulcerosa aumentano il rischio. Suscettibilità ereditarie (2-5%) sono dovute a mutazioni genetiche in sindromi come FAP e Lynch. La diagnosi si effettua con pancolonscopia e biopsia. La stadiazione richiede TC torace-addome-pelvi, e per i tumori del retto medio-basso, RM pelvica. Lo screening per il sangue occulto nelle feci ha migliorato la diagnosi precoce e la sopravvivenza. Per i tumori localizzati (stadio I-III), è indicata la chirurgia laparoscopica o laparotomica, seguita da chemioterapia adiuvante con fluoropirimidina e oxaliplatino negli stadi avanzati. Per i tumori del retto avanzati, si richiede chemio-radioterapia pre-operatoria. Recenti studi suggeriscono radioterapia short course e chemioterapia di induzione o consolidamento in strategie TNT. Nei pazienti con remissione clinica completa, si valuta la strategia watch and wait. Per tumori con instabilità dei microsatelliti, il dostarlimab ha mostrato efficacia.
Nei tumori metastatici (stadio IV), si esegue la caratterizzazione molecolare per valutare RAS e BRAF. Tumori RAS e BRAF wild type sono il 35-40%. Il trattamento include chemioterapia con fluoropirimidina, irinotecan e oxaliplatino, associati a farmaci biologici anti-EGFR o antiangiogenici. Nei pazienti fragili può essere usata solo la fluoropirimidina con bevacizumab. Dalla terza linea, farmaci orali come trifluridina/tipiracil o regorafenib sono efficaci. Frugquintinib è attivo in quarta linea.
Per tumori metastatici con instabilità dei microsatelliti, il pembrolizumab è più efficace della chemioterapia. La combinazione ipilimumab e nivolumab è superiore in alcuni casi. In pazienti con mutazioni BRAF, encorafenib e cetuximab sono efficaci. Per mutazioni KRASG12C, adagrasib e sotorasib sono promettenti. In pazienti con amplificazione HER2, trastuzumab e lapatinib sono attivi. Altre combinazioni includono pertuzumab con trastuzumab e tucatinib con trastuzumab.
Per metastasi epatiche e/o polmonari resecabili o diventate resecabili, è indicata la chirurgia della metastasi. Studi recenti valutano il trapianto di fegato per pazienti con metastasi epatiche non resecabili, possibile solo in studi clinici.
Tumori del Fegato

Oltre il 70% dei tumori primitivi del fegato è legato a fattori di rischio noti, come le infezioni da virus dell’epatite C (HCV) e B (HBV). Nel Nord Italia, circa un terzo dei casi è dovuto all’abuso di alcol. Negli ultimi anni, l’età alla diagnosi è aumentata e i casi “non virali”, legati a obesità e diabete, sono in crescita, influenzati dalla vaccinazione anti-HBV e dalle terapie antivirali per l’HCV, oltre allo stile di vita occidentale. La sorveglianza con ecografia epatica semestrale dei soggetti a rischio, come cirrotici o con epatite cronica avanzata, permette diagnosi precoci di HCC e trattamenti curativi (trapianto di fegato, resezione epatica, termoablazione), migliorando la sopravvivenza. La diagnostica si avvale di imaging e biopsie, con il trattamento dipendente dall’estensione della malattia e dalla funzionalità epatica. Algoritmi come il Barcelona Clinic Liver Cancer (BCLC) guidano i trattamenti, ora basati sull’efficacia (gerarchia terapeutica). Trapianto, resezione e termoablazione sono prioritari in assenza di metastasi. Nei casi non trattabili, la chemio-embolizzazione arteriosa (TACE) è indicata. Recentemente, l’associazione di terapie sistemiche alla TACE ha migliorato la sopravvivenza rispetto alla sola TACE, anche se non rimborsate dal Servizio Sanitario Nazionale. Nei casi avanzati, pazienti con funzionalità epatica buona possono ricevere immunoterapia combinata (atezolizumab e bevacizumab o tremelimumab e durvalumab), che ha mostrato vantaggi rispetto al sorafenib, il primo inibitore multichinasico efficace. Sorafenib e lenvatinib sono usati in prima linea se l’immunoterapia è controindicata. In pazienti pretrattati con sorafenib, regorafenib e cabozantinib hanno mostrato efficacia, mentre il ramucirumab è attivo in quelli con alfa-FP ≥400 ng/ml, pur non essendo rimborsato. Non c’è uno standard per la terapia di seconda linea post-immunoterapia, ma in Italia, sorafenib è rimborsato in questo contesto. La radioterapia interna selettiva (SIRT) con ittrio 90, confrontata con sorafenib, non ha migliorato la sopravvivenza, ma ha una migliore tollerabilità e impatto sulla qualità di vita. La chemioterapia sistemica ha scarsa efficacia nell’epatocarcinoma.
Tumore del PACREAS
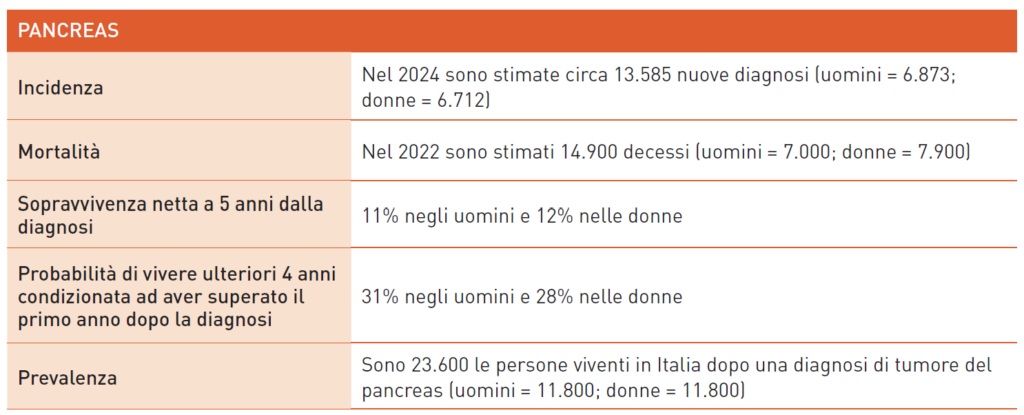
Il fumo è il principale fattore di rischio per il carcinoma pancreatico. Altri rischi includono obesità, sedentarietà, consumo eccessivo di alcol e grassi saturi, e bassa assunzione di frutta e verdura. Patologie come pancreatite cronica, diabete mellito e gastrectomia pregressa aumentano il rischio. Il 10% dei pazienti presenta una storia familiare, spesso legata a sindromi come Peutz-Jeghers, sindrome dei nevi atipici multipli e melanoma, mutazione BRCA2, pancreatite ereditaria e sindrome di Lynch. Varianti dei loci genomici dei gruppi sanguigni AB0 sono correlate a un rischio maggiore di tumori pancreatici. Diagnosi e stadiazione possono richiedere eco-endoscopia, TC, RM e biopsia; il livello di CA19.9 è indicativo. Meno del 20% è candidabile a chirurgia curativa, con sopravvivenza a 5 anni del 20%.
La chemioterapia adiuvante con 5-fluorouracile/acido folinico o gemcitabina migliora la sopravvivenza rispetto alla sola chirurgia. Gemcitabina e 5-fluorouracile/acido folinico mostrano risultati simili. Il regime gemcitabina/capecitabina offre un vantaggio in sopravvivenza, nonostante limiti metodologici. Un regime a 3 farmaci (5-fluorouracile/acido folinico, oxaliplatino, irinotecan) ha mostrato vantaggi rispetto alla gemcitabina, ma con più tossicità. Il regime nab-paclitaxel/gemcitabina non ha raggiunto l’obiettivo in sopravvivenza libera da malattia. La radio-chemioterapia post-operatoria è limitata a chirurgia non radicale. Nella malattia localmente avanzata, il trattamento neoadiuvante con FOLFIRINOX e nab-paclitaxel/gemcitabina o chemio-radioterapia può essere seguito da chirurgia e chemioterapia post-chirurgica. Il trattamento neoadiuvante è considerato anche per tumori resecabili.
Tumore della Colecisti e delle Vie Biliari

Il carcinoma delle vie biliari è un gruppo di tumori maligni che include il colangiocarcinoma intraepatico (iCCA), extraepatico peri-ilare (pCCA), extraepatico distale (dCCA) e il tumore della colecisti. Calcoli biliari e infiammazione cronica del dotto biliare sono i principali fattori di rischio, insieme a malattie infiammatorie intestinali, obesità, fumo ed esposizione ad agenti ambientali. Sebbene esista familiarità, il rischio rimane basso.
Non ci sono metodi di diagnosi precoce per questo carcinoma, spesso asintomatico per lungo tempo. Mancano test di screening efficaci; i tumori sono spesso diagnosticati in fase avanzata, caratterizzati dall’ittero dovuto all’ostruzione del dotto biliare. La resezione chirurgica completa con margini negativi è l’unico trattamento curativo possibile, variando a seconda della localizzazione del tumore. Per i tumori alla colecisti resecabili, è indicata la colecistectomia con resezione limitata e linfoadenectomia portale.
Trattamenti adiuvanti con 5-fluorouracile o gemcitabina possono essere efficaci, ma molti pazienti presentano malattia avanzata o metastatica alla diagnosi. Recidive sono comuni dopo resezione curativa. Chemioterapia è la principale opzione terapeutica per tumori non resecabili o recidivi, con il regime cisplatino-gemcitabina che offre benefici in sopravvivenza rispetto alla monoterapia. Lo studio TOPAZ-1 ha migliorato i risultati con l’aggiunta di durvalumab al regime.
I dati sui trattamenti di seconda linea sono limitati, ma la chemioterapia a base di fluoropirimidina è considerata un’opzione. La caratterizzazione molecolare ha identificato alterazioni genetiche come bersagli per la medicina di precisione. L’ivosidenib è approvato per mutazioni IDH1, mentre pemigatinib e futibatinib sono approvati per fusioni di FGFR2. Inoltre, pembrolizumab è disponibile per pazienti con alta instabilità dei microsatelliti, e larotrectinib/entrectinib per fusioni NTRK. Altre analisi molecolari potrebbero guidare trattamenti target, sebbene non rimborsati in Italia.
Tumore del Polmone
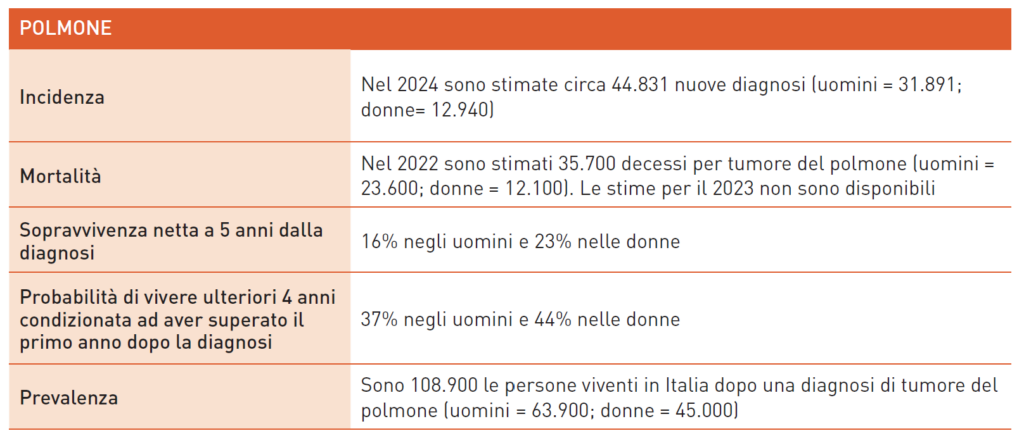
L’alto tasso di incidenza del tumore al polmone, sia negli uomini che nelle donne, e le statistiche di mortalità impongono di non dimenticare l’importanza della prevenzione primaria, in particolare della lotta al fumo, principale fattore di rischio. La maggior parte dei tumori polmonari è costituita da NSCLC, mentre il microcitoma rappresenta una minoranza. Attualmente, solo una piccola percentuale di NSCLC viene diagnosticata in stadio iniziale, candidati potenzialmente all’intervento chirurgico seguito da chemioterapia. Lo screening per il tumore del polmone nei forti fumatori ha dimostrato una riduzione della mortalità specifica e un aumento delle diagnosi precoci. In Italia, lo screening non è incluso nei programmi pubblici, ma le linee guida AIOM 2024 raccomandano un controllo annuale con TC torace per fumatori ed ex-fumatori. Dal 2022, il programma R.I.S.P. mira a reclutare 10.000 candidati ad alto rischio in 18 Centri italiani.
La terapia per NSCLC avanzato è cambiata, con novità diagnostiche importanti come la caratterizzazione molecolare. Le terapie mirate e l’immunoterapia hanno rivoluzionato i trattamenti. Gli inibitori EGFR e altri farmaci mirati hanno dimostrato superiorità rispetto alla chemioterapia per tumori con specifiche alterazioni molecolari. Nuovi farmaci mirati si stanno sviluppando per alterazioni molecolari finora senza trattamento. Risultati promettenti sono stati ottenuti con farmaci contro la mutazione G12C di KRAS. La ricerca progredisce anche per mutazioni con trattamenti esistenti come EGFR e ALK. Risultati recenti mostrano che osimertinib è efficace dopo chemio-radioterapia nei casi avanzati con mutazione EGFR.
L’immunoterapia, inizialmente usata dopo la chemioterapia fallita, ora è impiegata come trattamento di prima linea, sia come alternativa alla chemioterapia nei casi con alta espressione di PD-L1, sia in combinazione con chemioterapia negli altri casi. Recentemente, farmaci innovativi hanno mostrato dati importanti anche negli stadi precoci, riducendo i rischi di recidiva. Lo studio ADAURA ha dimostrato che osimertinib aumenta la sopravvivenza nei casi operati con mutazione EGFR. Nel caso ALK+, l’alectinib ha mostrato benefici rispetto alla chemioterapia adiuvante.
Nel SCLC, tumore aggressivo associato al fumo, l’aggiunta dell’immunoterapia alla chemioterapia ha portato a risultati interessanti, anche se limitati nel controllo duraturo. All’ASCO 2024, risultati con durvalumab dopo chemio-radioterapia hanno mostrato benefici nel SCLC limitato. Tuttavia, con una sopravvivenza a 5 anni del 16% negli uomini e 23% nelle donne, il tumore al polmone rimane una sfida, e la prevenzione resta cruciale.
Melanomi
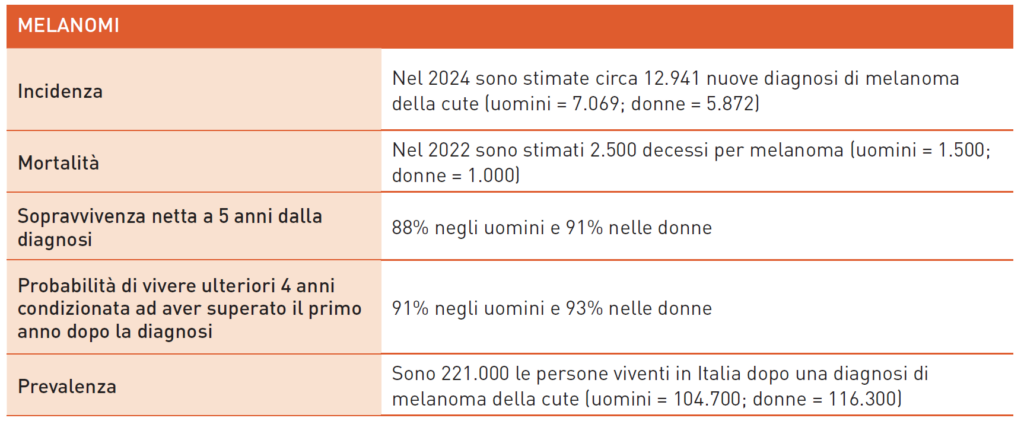
Circa l’85% dei melanomi cutanei nel mondo colpisce Nord-America, Europa e Oceania, risultando uno dei tumori più comuni nei giovani e il terzo più frequente in Italia sotto i 50 anni. Il rischio di melanoma è influenzato da fattori genetici, fenotipici, ambientali e dalla combinazione di questi. L’esposizione ai raggi UV, soprattutto intermittente e in età giovanile, è il principale fattore di rischio ambientale. I lettini abbronzanti aumentano significativamente il rischio di melanoma, soprattutto se usati in giovane età. La chirurgia è il trattamento primario per il melanoma iniziale. La biopsia del linfonodo sentinella è utilizzata per la stadiazione in melanomi >0,8 mm o ulcerati. In caso di positività, la dissezione linfonodale non è più necessaria, ma rimane indicata per metastasi linfonodali evidenti.
L’introduzione di nuovi agenti immunoterapici e target ha trasformato il trattamento del melanoma avanzato. La mutazione V600 del gene BRAF presente nel 40-50% dei melanomi identifica i pazienti che beneficiano di terapie combinate come dabrafenib/trametinib. Mutazioni dei geni NRAS e cKIT sono trattabili con inibitori specifici. In Italia, imatinib è approvato per melanomi metastatici con mutazione cKIT. L’immunoterapia e la terapia target offrono benefici a lungo termine nel 50% dei pazienti metastatici. La combinazione ipilimumab/nivolumab è approvata per melanoma avanzato ed è considerata la prima opzione per metastasi cerebrali asintomatiche. La combinazione nivolumab + relatlimab ha mostrato superiorità rispetto alla monoterapia. Il trattamento adiuvante è indicato per casi ad alto rischio di recidiva. Pembrolizumab e nivolumab sono approvati per il trattamento adiuvante di stadi avanzati. Studi indicano la superiorità del trattamento neoadiuvante, ma non è ancora rimborsato.
La chemioterapia è riservata ai casi in cui altre terapie sono inefficaci. Nei melanomi oculari, le mutazioni tipiche sono nei geni GNAQ e GNA11. Tebentafusp ha mostrato superiorità in sopravvivenza per pazienti con HLA-A*0201 ed è approvato da FDA, EMA e AIFA. Per gli altri pazienti, il trattamento di prima linea è con anti-PD-1, seguito da ipilimumab. La chemioterapia rimane un’opzione in caso di fallimento delle altre terapie.
Mesotelioma
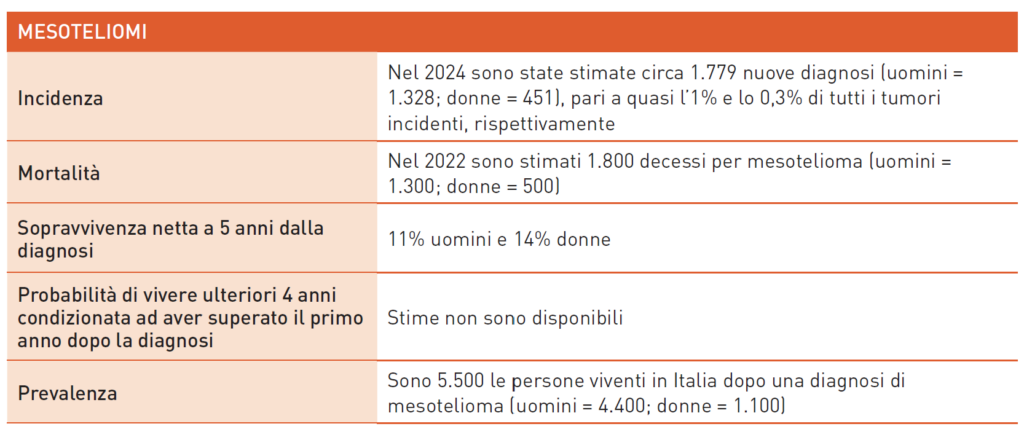
Il mesotelioma è la neoplasia maligna più comune del mesotelio, originando da pleura, peritoneo, pericardio o tunica vaginale del testicolo. Il rischio principale è l’esposizione all’asbesto (90% dei casi), sia essa professionale, ambientale o familiare. Altri casi sono legati a radiazioni ionizzanti o fattori ereditari. Esiste un sistema di sorveglianza nazionale, con dati raccolti nel Registro Nazionale Mesoteliomi (ReNaM). Nonostante il divieto dell’asbesto in Italia da oltre 30 anni, l’incidenza non è diminuita. Il sintomo principale è la dispnea. La diagnosi avviene tramite biopsie pleuriche con toracoscopia video-assistita (VATS); in alternativa, si può ricorrere a una biopsia percutanea. L’istologia più comune è epitelioide (70-85%), mentre sarcomatoide e bifasica sono più rare. La classificazione OMS include il mesotelioma diffuso e localizzato, oltre al mesotelioma in situ, una proliferazione pre-invasiva.
Per il mesotelioma pleurico epitelioide, il trattamento standard è la chemioterapia con derivati del platino e pemetrexed. Dal settembre 2022, ipilimumab e nivolumab sono il trattamento standard per istologie non-epitelioidi. La chirurgia è generalmente palliativa. Uno studio di fase 3 (MARS-2) non ha dimostrato la superiorità della chirurgia dopo chemioterapia. Attualmente, la chirurgia è proposta solo in casi specifici e in programmi multimodali. Il trattamento di seconda linea può includere gemcitabina o vinorelbina. Uno studio di fase 2 ha mostrato un aumento della sopravvivenza con ramucirumab e gemcitabina. Ramucirumab è nell’elenco AIFA per il trattamento di seconda linea. Nella immunoterapia, uno studio ha mostrato un aumento della sopravvivenza con nivolumab rispetto a placebo nei pazienti pretrattati. Il CSE di AIFA ha dato parere favorevole per nivolumab nei pazienti pretrattati con mesotelioma epitelioide.
A causa della rarità e della prognosi negativa, è fondamentale partecipare a studi clinici. L’eliminazione progressiva dell’asbesto è essenziale per ridurre l’incidenza della malattia.
Sarcomi dei Tessuti Molli
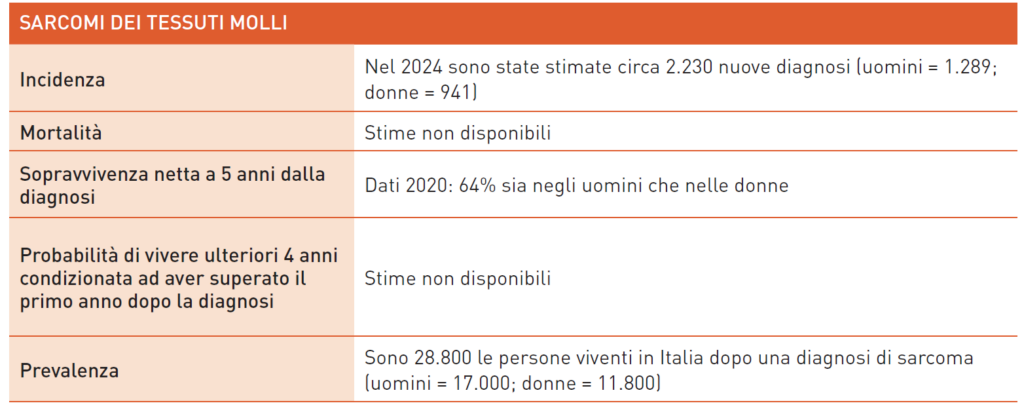
I sarcomi dei tessuti molli (STM) sono tumori rari con circa 5 casi ogni 100.000 abitanti all’anno, rappresentando l’1% dei tumori negli adulti. In Italia, nel 2020, sono state stimate 2.300 nuove diagnosi (1.400 uomini, 900 donne). La sopravvivenza a 5 anni è del 64%. Circa 28.800 persone vivono dopo una diagnosi di STM (17.000 uomini, 11.800 donne). Presentano tre picchi: infanzia, giovane età adulta (18-30 anni) e anziana (>65 anni). Sono diffusi ovunque nel corpo ma più frequenti in arti (18% superiori, 46% inferiori), retroperitoneo (13%), visceri (15%), tronco (8%), distretto ORL (5%). I sarcomi uterini costituiscono circa il 5% dei tumori uterini e l’1-3% di quelli genitali femminili, suddivisi in leiomiosarcoma, sarcoma dello stroma endometriale, sarcoma indifferenziato e adenosarcoma. Il carcinosarcoma dell’utero è ora classificato come carcinoma endometriale. Esistono oltre 80 sottotipi istologici di STM (WHO 2020), identificati per origine tessutale, ma l’integrazione tra diagnosi morfologica, immunoistochimica e molecolare è cruciale. Importante anche il grading per distinguere i sarcomi in basso, intermedio e alto grado. La differenza in diagnosi tra anatomopatologi può arrivare al 20-30%, evidenziando la necessità di centri di riferimento per la diagnosi. Pochi i fattori di rischio noti, tra cui cause genetiche (Li-Fraumeni, Neurofibromatosi, FAP), fisiche (radiazioni X), chimiche (diossina, cloruro di vinile) e virali (HBV, HHV8). L’associazione tra trauma, infiammazione cronica e sarcomi è ancora incerta. I fattori prognostici includono volume della neoplasia, sede, tipo istologico, grading, trattamento chirurgico, trattamento in centri specializzati, recidiva e presenza di metastasi. Diagnosi: masse sopra i 5 cm nei tessuti superficiali e sopra i 3 cm nei profondi devono essere sospettate come STM. Masse in rapido accrescimento o ematomi spontanei devono essere attentamente controllati. La diagnosi di sarcomi retroperitoneali e uterini è complessa e spesso tardiva. Non esistono screening efficaci per STM; la rarità della patologia e l’assenza di un esame specifico lo impediscono. Importante è la diagnosi precoce e sensibilizzare popolazione e medici. I pazienti devono essere inviati a centri di riferimento per un miglior risultato diagnostico e terapeutico. Il PSDTA include anamnesi, esame obiettivo, esame clinico, ecografia della massa per dimensioni, vascolarizzazione e sede. Nei STM degli arti può essere utile la radiografia del segmento osseo adiacente. La RM della regione anatomica, la biopsia e l’esame istologico completano la diagnosi. La TAC torace e addome esclude metastasi. Gli esami molecolari aggiungono precisione ma non sostituiscono la diagnosi morfologica. In rari casi, come nei sarcomi NTRK positivi, permettono accesso a terapie mirate. Una volta ottenuta la diagnosi, il caso va discusso in team multidisciplinare. L’exeresi chirurgica è fondamentale, con margini ampi o radicali. Nelle forme ad alto grado è prevista la radioterapia adiuvante. La chemioterapia adiuvante è un’opzione per casi ad alto rischio di recidiva, offrendo un vantaggio del 5% sulla sopravvivenza globale. La terapia neoadiuvante (chemio e radioterapia) può essere offerta per facilitare la chirurgia conservativa. I benefici sulla sopravvivenza sono simili alla chemioterapia adiuvante. Non vi è evidenza di efficacia della chemio-radioterapia neoadiuvante nei sarcomi retroperitoneali e uterini. La radioterapia non è proposta per i sarcomi retroperitoneali a causa degli effetti collaterali. Il follow-up è personalizzato in base al rischio di recidiva, con controlli ogni 4–6 mesi per forme ad alto rischio e ogni 6–12 mesi per quelle a basso rischio. Importante è monitorare l’area operata e il torace per metastasi polmonari. Malattia metastatica: nel 50% dei casi, la malattia è in stadio IV alla prima diagnosi o diventa metastatica dopo l’intervento. Il polmone è la sede principale di recidiva. Nei sarcomi uterini e retroperitoneali, temibile è la recidiva locale. Se operabili, le metastasi polmonari vanno rimosse chirurgicamente. Se non operabili, si interviene con terapia medica. La polichemioterapia aumenta le risposte obiettive ma non migliora il tempo alla progressione, fermo a 4 mesi. Farmaci attivi includono antracicline, ifosfamide, dacarbazina, trabectedina, gemcitabina, eribulina e pazopanib. Solo in alcuni istotipi ci sono evidenze di attività per farmaci immunologici, ma non sono rimborsabili dal SSN in Italia. La terapia di supporto durante la chemioterapia è sempre considerata per ridurre gli effetti collaterali e migliorare la qualità di vita. La sopravvivenza mediana con malattia metastatica è di circa 12 mesi. Negli ultimi anni, si è sviluppata una terapia basata sull’istotipo, evidenziando che alcune forme sono più sensibili a specifici farmaci. Esempi includono: imatinib nel dermatofibrosarcoma protuberans, paclitaxel e gemcitabina negli angiosarcomi, trabectedina nel liposarcoma mixoide, dacarbazina nel tumore fibroso solitario e leiomiosarcoma, ifosfamide nel sinovialsarcoma. Alcuni istotipi beneficiano di terapie successive alla prima, ma con risultati limitati nel tempo. Data la complessità della diagnosi e delle scelte terapeutiche, si auspica che i casi di STM siano discussi in un contesto multidisciplinare, in collaborazione con centri di riferimento.
Tumore della Mammella
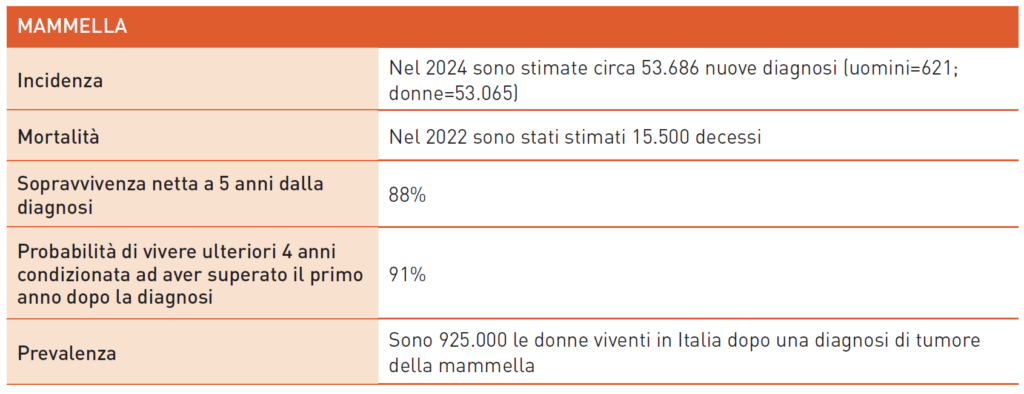
Il carcinoma mammario è il tumore più comune tra le donne in Italia. I principali fattori di rischio includono: età, fattori riproduttivi e ormonali, dieta, stile di vita, radioterapia toracica pregressa, displasie o neoplasie mammarie precedenti, familiarità ed ereditarietà.
Malattia in stadio iniziale
Grazie a screening e consapevolezza, la maggior parte dei tumori mammari viene diagnosticata precocemente, consentendo trattamenti chirurgici conservativi e terapie più efficaci, con alte sopravvivenze a 5 anni. Il trattamento standard prevede chirurgia conservativa con radioterapia o mastectomia, seguita da terapia adiuvante sistemica (ormonoterapia, polichemioterapia, terapie mirate) per ridurre il rischio di recidiva e morte. La terapia adiuvante viene personalizzata in base a stadio, caratteristiche del tumore, tossicità, preferenze della paziente, comorbidità e aspettativa di vita. Per i tumori a recettori ormonali positivi/HER2-negativo, sono disponibili classificatori genomici per pazienti a rischio intermedio. Per pazienti ad alto rischio di recidiva, sono disponibili abemaciclib e pertuzumab. La terapia neoadiuvante è indicata per tumori avanzati inoperabili, per rendere il tumore operabile o aumentare le possibilità di chirurgia conservativa. Disponibili strategie post-operatorie come capecitabina e TDM1 per pazienti con malattia residua. Pembrolizumab è disponibile per tumori triplo-negativi, mentre pertuzumab è indicato per HER2+. Olaparib è disponibile per mutazioni BRCA1/2.
Malattia metastatica
Il 6-7% dei tumori mammari è metastatico alla diagnosi. La maggior parte delle pazienti con carcinoma metastatico ha avuto una recidiva dopo una forma iniziale. Progressi diagnostici e nuovi farmaci hanno aumentato la sopravvivenza. Il trattamento si basa su parametri biologici e caratteristiche del tumore, situazione psico-fisica e trattamenti precedenti. Nei tumori HER2-positivi, il doppio blocco anti-HER2 con taxano è standard di prima linea, seguito da trastuzumab-deruxtecan. Altre opzioni includono TDM1 e tucatinib. Per tumori HR+ e HER2-negativo, gli inibitori delle cicline CD4/6, elacestrant e talazoparib sono disponibili. Nei tumori triplo-negativi, immunoterapia con chemioterapia è standard di prima linea. Sacituzumab govitecan è un’opzione per tumori avanzati. Olaparib e talazoparib sono disponibili per mutazioni BRCA1/2. Trastuzumab deruxtecan è autorizzato per HER2 low. La chemioterapia rimane il gold standard per tumori triplo-negativi e ormonosensibili non rispondenti.
Cervice Uterina
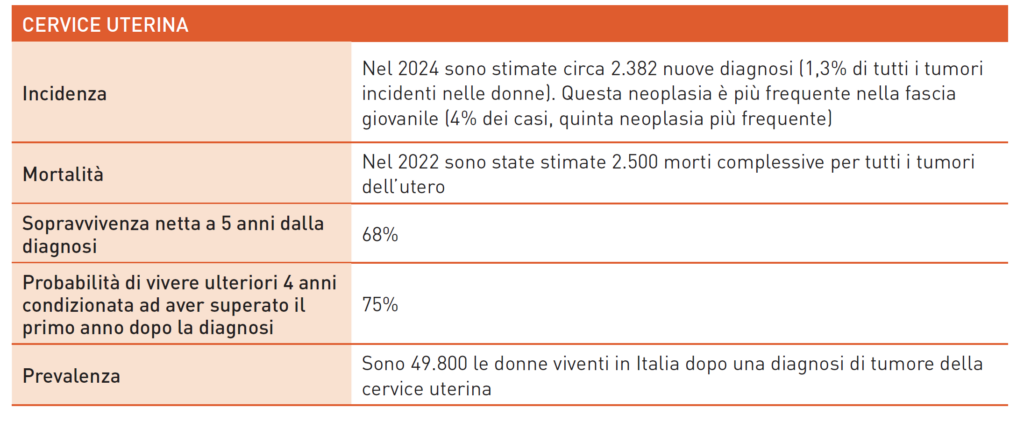
Il carcinoma della cervice uterina è il secondo tumore più comune tra le donne dopo il tumore al seno. L’infezione persistente da Papilloma virus (HPV) trasmessa sessualmente è il principale fattore eziologico, mentre i fattori di rischio includono condizioni che favoriscono l’infezione, come basso livello socioeconomico, numero di partner, inizio precoce dell’attività sessuale e parità. Il tumore squamoso è il più comune, mentre l’adenocarcinoma rappresenta il 10-15% delle diagnosi. La diagnosi precoce è cruciale: i programmi di screening con Pap-test e HPV test hanno ridotto significativamente l’incidenza e la mortalità. La prevenzione primaria tramite vaccini anti-HPV, offerti a persone dai 12 ai 26 anni, è essenziale. Nelle fasi precoci (tumori sotto i 4 cm confinati alla cervice), si utilizza la chirurgia; nei casi avanzati, si ricorre a radio-chemioterapia con platino e brachiterapia. Nei tumori microinvasivi o <2 cm, l’approccio conservativo è un’opzione in centri specializzati. Linfoadenectomia è necessaria dallo stadio IA2. L’approccio laparoscopico è associato a un rischio maggiore di recidiva; quindi, la laparotomia è la tecnica preferita. La chemioterapia neoadiuvante non è più standard per malattie avanzate. L’aggiunta di chemioterapia sistemica alla radio-chemioterapia non migliora la sopravvivenza. L’eviscerazione chirurgica è indicata per recidive post-terapia standard. Nella malattia metastatica (stadio IVB), si opta per palliazione con chemioterapia a base di platino e taxani. L’aggiunta di bevacizumab alla chemio incrementa leggermente la sopravvivenza. Lo studio Keynote 826 ha dimostrato che l’aggiunta di pembrolizumab alla chemio migliora significativamente la sopravvivenza totale e libera da progressione, diventando il nuovo standard. Dopo fallimento della prima linea, le risposte alla chemio sono inferiori al 10% con OS mediana di 8 mesi. Lo studio Empower cervical-1 ha evidenziato che cemiplimab aumenta la sopravvivenza nei casi avanzati e metastatici. Recentemente, un anticorpo farmaco coniugato, tisotumab vedotin, ha mostrato un vantaggio mediano di 2 mesi rispetto alla chemio di seconda linea, con tossicità da gestire.
Tumori dell’ ENDOMETRIO
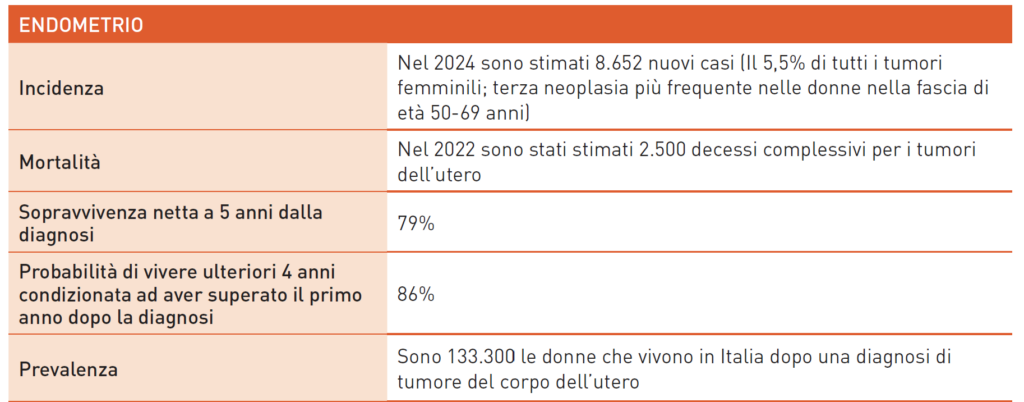
Il carcinoma endometriale è tra i tumori femminili più comuni, con incidenza e mortalità in crescita. I fattori di rischio delle forme ormono-sensibili includono nulliparità, menopausa tardiva, obesità, diabete, ipertensione e terapia ormonale sostitutiva sbilanciata. Le neoplasie estrogeno-indipendenti sono legate a radioterapia pelvica o tamoxifene. Il sintomo iniziale è il sanguinamento uterino anomalo, permettendo spesso la diagnosi precoce. L’ecografia transvaginale studia la rima endometriale, ma l’isteroscopia con biopsia è fondamentale. Il trattamento standard prevede isterectomia laparoscopica con annessiectomia bilaterale e valutazione del linfonodo sentinella. I tumori dell’endometrio sono classificati per rischio e trattamento adiuvante. La recente classificazione molecolare identifica 4 classi: POLE mutati, MSI o MMRd, NSMP e p53 mutati. Le caratteristiche cliniche e molecolari determinano il rischio e il trattamento adiuvante.
Basso rischio: tumori G1-G2 con infiltrazione miometriale <50% senza LVSI (stadio IA G1-G2, no LVSI), tumori POLE mutati stadio I-II e NSMP o MMRd stadio IA G1-G2 senza LVSI. Queste pazienti non necessitano di terapia adiuvante. Rischio intermedio: tumori G1-G2 con infiltrazione miometriale >50% senza LVSI (IB G1-G2, no LVSI) o clinicamente simili a MMRd, NSMP o p53 mutati. Queste pazienti possono ricevere brachiterapia adiuvante o osservazione, specie sotto i 60 anni. Rischio intermedio alto: tumori endometrioidi stadio I con LVSI, tumori poco differenziati con infiltrazione miometriale >50% (stadi FIGO IBG3), tumori stadio II o clinicamente simili a MMRd o NMSP. La terapia si basa sullo stato linfonodale, con brachiterapia o radioterapia esterna se sconosciuto, e chemioterapia per linfonodi non noti, G3 o LVSI.
Alto rischio: tumori endometrioidi stadio IIII-IV senza residuo, tumori non endometrioidi stadio I-IV o clinicamente simili a MMRd, NSPM o p53 mutati. La terapia adiuvante combina chemioterapia con carboplatino-paclitaxel per 4 cicli e radioterapia, o solo chemioterapia per 6 cicli. Pazienti ad alto rischio hanno fino al 40% di rischio di recidiva. Il trattamento standard avanzato/metastatico combina carboplatino-paclitaxel. Recenti dati mostrano che l’aggiunta di immunoterapia (pembrolizumab o dostarlimab) migliora PFS e OS, con maggiore beneficio nelle pazienti dMMR. Dostarlimab è disponibile in Italia per pazienti dMMR. Studi suggeriscono che il parp inibitore olaparib con PDL1 inibitore durvalumab aumenti la PFS rispetto alla sola chemioterapia in pazienti pMMR. In progressione alla prima linea, non c’è uno standard di seconda linea: doxorubicina e paclitaxel settimanale mostrano risposte del 15-20% e sopravvivenza libera da progressione di circa 4 mesi. L’ormonoterapia con progestinici o inibitori dell’aromatasi è consigliata per tumori di grado 1 a progressione lenta. La combinazione di lenvatinib e pembrolizumab migliora PFS, OS e risposta rispetto alla chemioterapia in seconda linea e è approvata da AIFA. In Italia, dostarlimab e pembrolizumab sono approvati per MSI-I recidivati dopo terapia a base di platino.
Tumori dell’ OVAIO

Il tumore ovarico è uno dei principali killer tra le neoplasie ginecologiche (30%) e si colloca al decimo posto tra i tumori femminili (3%). L’alta mortalità è dovuta a sintomi tardivi e assenza di screening precoce, tranne per donne con mutazioni BRCA1 e BRCA2. Circa il 75-80% delle pazienti riceve una diagnosi in stadio avanzato (FIGO III-IV); solo il 10% presenta una neoplasia limitata alle ovaie o alla pelvi (FIGO I-II), spesso scoperta durante controlli di routine. I fattori di rischio includono stimolazione ovarica (nulliparità, infertilità, gravidanza oltre i 35 anni), storia familiare di tumori, e alterazioni genetiche come BRCA1 e BRCA2. I tumori germinali costituiscono il 15-20% delle neoplasie ovariche, ma solo il 5% è maligno, spesso diagnosticati prima dei 20 anni. Le forme epiteliali sono più comuni (60%), colpendo donne in età riproduttiva e post-menopausale. Le forme sierose di alto grado rappresentano il 70% dei tumori epiteliali e sono spesso legate a difetti nei meccanismi di riparazione del DNA (HRR), rendendoli più sensibili a chemioterapici e inibitori PARP. È cruciale effettuare il test genetico per mutazioni BRCA1 e BRCA2 nelle pazienti con tumore epiteliale non mucinoso. Anche senza mutazioni specifiche, il 30% dei casi può mostrare un deficit di riparo del DNA (HRd).
La chirurgia è curativa nel 70% dei casi in stadio iniziale, ma il rischio di recidiva del 25-30% può richiedere chemioterapia adiuvante con carboplatino, da solo o con paclitaxel. Nel carcinoma avanzato (FIGO III-IV), la chirurgia radicale è il trattamento principale; l’assenza di residuo tumorale è un fattore prognostico positivo. Anche in caso di recidiva, l’asportazione completa della malattia visibile migliora la sopravvivenza quando effettuata in centri specializzati. Per pazienti non operabili, la chemioterapia neoadiuvante è un’alternativa, con carboplatino/paclitaxel come trattamento standard. Negli ultimi anni, l’introduzione dei PARP-inibitori ha ridotto la mortalità, migliorando la sopravvivenza globale, soprattutto per chi presenta mutazioni BRCA1 e BRCA2. Tuttavia, il 70% delle pazienti in stadio avanzato recidiva entro due anni.
Fino a dieci anni fa, la chemioterapia era l’unica opzione per il tumore ovarico. Ora, farmaci “targeted” come bevacizumab e PARP-i sono disponibili per gli stadi avanzati, utilizzati con la chemioterapia o come mantenimento. Gli inibitori PARP sono efficaci nelle pazienti con profilo molecolare BRCA mutato o HRd, ritardando la recidiva oltre 3 anni. Il test BRCA è essenziale al momento della diagnosi. La combinazione di bevacizumab e olaparib prolunga la sopravvivenza nelle pazienti con HRd. Tuttavia, un’importante sfida resta il trattamento delle pazienti resistenti ai platino-derivati, specialmente dopo PARP-i. Nuovi studi clinici mirano a superare questa resistenza, con combinazioni promettenti tra anti-angiogenici e PARP-inibitori, che presto entreranno nella pratica clinica.
Tumore della PROSTATA

Il carcinoma prostatico è diventato il tumore più comune negli uomini occidentali nell’ultimo decennio. Questo è dovuto più alla diagnosi precoce tramite screening come il PSA, esame digitorettale, ecografia prostatica e biopsia, piuttosto che a fattori di rischio. Inizialmente, il carcinoma prostatico è asintomatico, ma con la progressione possono insorgere sintomi urinari e dolore perineale. In stadi avanzati, il dolore osseo è comune a causa delle metastasi.
Per il tumore localizzato, sono proposti trattamenti come chirurgia o radioterapia, valutati da un team multidisciplinare. Nei pazienti a basso rischio, la sorveglianza attiva è un’opzione per posticipare il trattamento finché la malattia non diventa più aggressiva. La terapia di deprivazione androgenica (ADT) è il trattamento di riferimento, ma le cellule possono sviluppare resistenza, portando a CRPC. In CRPC non metastatico, l’aggiunta di ARPI all’ADT migliora la sopravvivenza. Nel CRPC metastatico, si usano chemioterapici e ARPI. Olaparib è impiegato nei pazienti con mutazione BRCA. Inoltre, Lutezio (177Lu) vipivotide tetraxetan è una nuova terapia target, ma non rimborsata in Italia, come altre combinazioni ARPI+PARPi.
Nuove strategie nel mCRPC sono rilevanti con l’uso anticipato di chemioterapia e ARPI in fasi precoci come nmCRPC e mHSPC. In mHSPC, si raccomanda l’intensificazione dell’ADT con docetaxel e/o un ARPI. È possibile trattare l’mHSPC oligometastatico con radioterapia sulla prostata insieme all’ADT.
Lo studio EMBARK ha mostrato l’efficacia di enzalutamide con ADT o da sola dopo progressione biochimica, suggerendo l’uso precoce di ARPI. Infine, gli studi sull’introduzione di nuove molecole si basano su imaging tradizionale, ma il crescente uso della PET-PSMA pone problemi di trasferibilità nella pratica clinica.
Tumori del TESTICOLO

I tumori del testicolo sono per il 95% germinali, comprendendo seminomi e non seminomi, con alta sensibilità alla chemioterapia e per i seminomi anche alla radioterapia. Questo spiega l’alto tasso di guarigione, circa il 99% nei primi stadi (limitati al testicolo) e leggermente inferiore nei secondi (coinvolgimento dei linfonodi addominali). Anche nelle forme avanzate, la guarigione raggiunge il 75-80%. Nei primi stadi, la scelta tra osservazione e trattamento attivo (chemioterapia con carboplatino AUC7 o PEB) dipende da fattori prognostici e dalle preferenze del paziente. Un trattamento attivo riduce il rischio di recidiva al 3-4%, ma la guarigione è ancora possibile con terapie più intense in caso di recidiva. Nei seminomi allo stadio IIA, la radioterapia è la scelta principale, mentre per lo stadio IIB si usa la PEB. La chirurgia retroperitoneale è un’opzione emergente per i seminomi allo stadio II.
Per le malattie avanzate, il regime PEB “classico” resta standard, con tre o quattro cicli in base alla prognosi. Nei non seminomi, la chirurgia è necessaria per rimuovere residui, in quanto potrebbero contenere elementi vitali o teratomi, che non rispondono alla chemio o radioterapia. Nei pazienti con progressione dopo la prima linea, la guarigione è possibile nel 25-40% dei casi con regimi contenenti cisplatino. La chemioterapia ad alte dosi con trapianto di cellule emopoietiche può aumentare il tasso di guarigione fino a oltre il 60% in seconda linea e fino al 40% in terza linea.
I marcatori tumorali (beta HCG, alfafetoproteina, LDH) sono cruciali per la stadiazione e il follow-up. Nuovi fattori prognostici negativi per il non seminoma avanzato includono età, LDH elevato e metastasi polmonari. La guarigione nei pazienti con poor risk è aumentata al 70% negli ultimi 25 anni. I miRNA stanno emergendo come strumenti per individuare residui di malattia attiva, specialmente nei pazienti senza marcatori classici. Si prevede un loro uso nel follow-up per anticipare le recidive. Il follow-up si sta demedicalizzando, concentrandosi sulle recidive nei primi 2-3 anni e sulla “conditional survival” dopo 2 anni. La criopreservazione dello sperma è fondamentale prima della chemioterapia. Il follow-up del paziente guarito include valutazioni multidisciplinari per identificare eventuali danni tardivi da trattamento.
Tumori del RENE
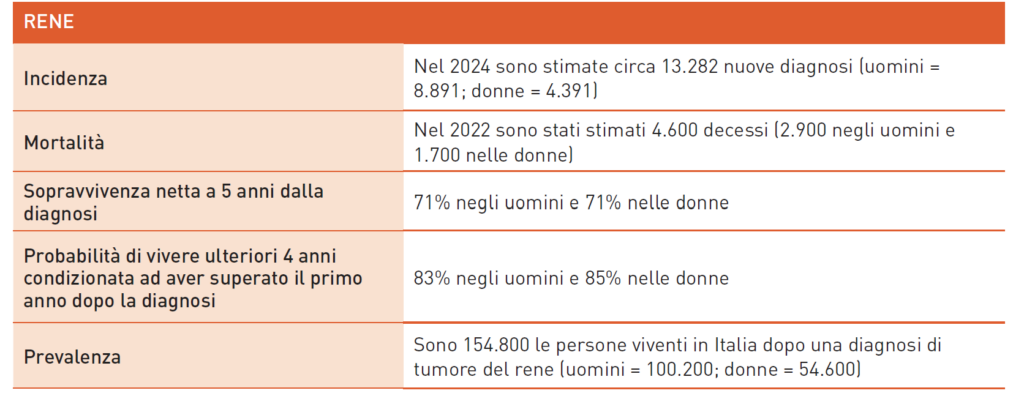
La diagnosi di carcinoma renale spesso avviene in modo “incidentale” durante un ecografia per altri motivi. Inizialmente, la malattia è asintomatica, dato che il tumore cresce perifericamente. Alla diagnosi, nel 55% dei casi, il tumore è confinato al rene, permettendo la rimozione chirurgica e la guarigione nel 50% dei pazienti. Tuttavia, nel 25-30% dei casi, il cancro è avanzato o metastatico. I fattori di rischio includono fumo, ipertensione, policistosi renale e obesità. Esistono rare forme ereditarie, come la sindrome di Von Hippel Lindau, con un rischio tumorale del 70% a 60 anni. Mancano marker tumorali specifici, con lo stadio, il grading e l’istotipo come principali fattori prognostici, insieme allo score prognostico IMDC per la malattia metastatica. La classificazione WHO/ISUP 2022 conferma la prevalenza del carcinoma a cellule chiare (75-80%) e include nuove entità diagnosticate con biologia molecolare. La sopravvivenza dei pazienti è in crescita, con un aumento di 25 e 11 punti percentuali negli USA e in Italia, grazie a terapie target e immunoterapiche. Nel 2022, l’EMA ha approvato pembrolizumab come terapia adiuvante per pazienti ad alto rischio di recidiva. La nefrectomia citoriduttiva per malattia metastatica va valutata caso per caso. Il trattamento della malattia metastatica è migliorato grazie alle terapie di combinazione, basate sullo score IMDC. I pazienti a rischio intermedio e sfavorevole hanno come prima scelta terapie combinate disponibili in Italia: ipilimumab + nivolumab, axitinib + pembrolizumab, cabozantinib + nivolumab e lenvatinib + pembrolizumab. Anche per pazienti a buona prognosi sono disponibili combinazioni e, in casi selezionati, monoterapia con TKI o sorveglianza attiva. Per linee successive, le opzioni dipendono dalla categoria di rischio e dal farmaco usato in prima linea: nivolumab, cabozantinib, axitinib, sunitinib, everolimus e sorafenib. Per le istologie non a cellule chiare, le strategie usate per la variante a cellule chiare sono efficaci, ma è utile valutare l’inclusione in trial clinici dedicati.
Tumore della Vescica
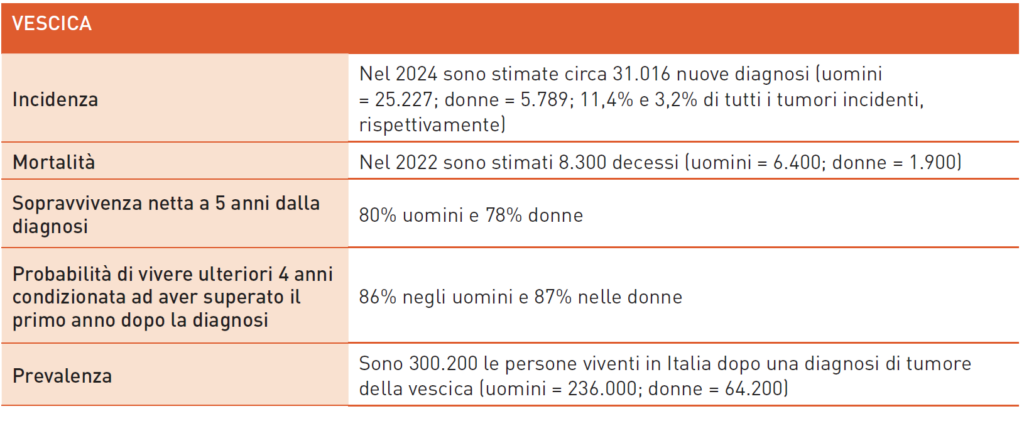
Oltre il 90% dei tumori della vescica, divisi in forme superficiali (CIS, Ta, T1) e muscolo-infiltranti (≥T2), sono carcinomi uroteliali, causati principalmente dal fumo di sigaretta. Il carcinoma uroteliale non è considerato ereditario, anche se ci sono alterazioni dei geni BRCA. Un rischio maggiore è stato osservato nelle famiglie con sindrome di Lynch per tumori dell’alta via escretrice.
Il trattamento varia tra forme superficiali e muscolo-infiltranti. Le forme superficiali si trattano con resezione endoscopica vescicale transuretrale (TUR-BT) e, in caso di conferma, con chemioterapia o immunoterapia post-operatoria. Per la malattia muscolo-infiltrante, la cistectomia radicale è il trattamento primario, spesso combinato con chemioterapia preoperatoria e ricostruzione vescicale. Opzioni neoadiuvanti e adiuvanti includono immunoterapici recenti. In alcuni casi si possono adottare strategie di preservazione della vescica con approcci trimodali.
Per malattia avanzata non operabile o metastatica, si utilizza polichemioterapia con platino, seguita da immunoterapia di mantenimento con avelumab. L’uso di Checkpoint Inhibitors è limitato a specifici casi e a seconda linea di trattamento. I nuovi farmaci immunoconiugati stanno cambiando il trattamento grazie alla loro efficacia e sicurezza. Studi recenti hanno mostrato risultati positivi con combinazioni di farmaci, come enfortumab vedotin e pembrolizumab, non ancora rimborsati in Italia.
Altri studi includono l’uso di erdafinitib per target specifici e inibitori di PARP. Nuove combinazioni di farmaci sono in fase di studio per verificare efficacia e tollerabilità, considerando la complicata situazione dei pazienti spesso anziani e con comorbidità. Lo scenario è in continua evoluzione e promettente.
Tumori del Sistema Nervoso Centrale (SNC)
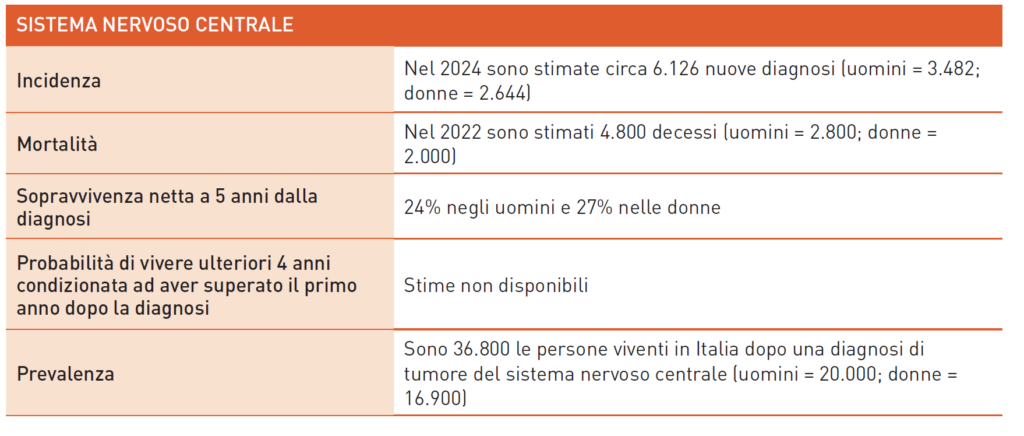
I tumori del sistema nervoso centrale (SNC) sono un gruppo eterogeneo per morfologia, sede, aspetti biologici e prognostici. Fattori di rischio includono esposizioni a radiazioni gamma e X, definite dalla IARC come cancerogeni del Gruppo 1 per i tumori del SNC. L’esposizione a campi elettromagnetici, compresi i telefoni cellulari, ha evidenza limitata. Alcune sindromi genetiche, come le neurofibromatosi e la sindrome di Li-Fraumeni, aumentano il rischio. È stato osservato un rischio familiare non associato a sindromi note. In Italia, l’incidenza è stabile, con tumori maligni più frequenti negli uomini. Non esistono test per la diagnosi precoce; i sintomi portano alla diagnosi. La prevenzione primaria suggerisce limitare l’uso dei cellulari. Il glioblastoma è il tumore maligno del SNC più comune negli adulti, con tasso di incidenza di 3-4 casi per 100 mila abitanti. L’età media di insorgenza è 65 anni, con sopravvivenza mediana di 15 mesi. Al momento della recidiva, è consigliabile inserire i pazienti in trial clinici. Le terapie di seconda linea includono lomustina e temozolomide. L’AIFA ha approvato il regorafenib basandosi sullo studio REGOMA. Il trial REGOMA-2 studia l’efficacia del regorafenib in prima linea. La targeted therapy ha visto risultati positivi: lo studio INDIGO ha dimostrato che il vorasidenib è efficace nei gliomi di basso grado IDH mutati. Miglioramenti significativi nella sopravvivenza libera da progressione e nel tempo al trattamento successivo sono stati osservati. Anche gli inibitori di BRAF e NTRK hanno mostrato efficacia. Studi in corso valutano nuovi trattamenti target. È cruciale l’inserimento in protocolli sperimentali presso Centri neuro-oncologici di riferimento.
Tumori della TIROIDE

I trend epidemiologici indicano che la sovra-diagnosi è la principale causa dell’aumento dell’incidenza del carcinoma differenziato della tiroide (DTC), sia papillare (PTC) che follicolare (FTC), soprattutto delle forme indolenti < 1cm. Non si sono osservate variazioni nell’incidenza di altri istotipi come il carcinoma midollare (MTC) e anaplastico della tiroide (ATC). I farmaci a bersaglio molecolare e i test per mutazioni target hanno modificato la gestione delle forme avanzate. Nel PTC, la mutazione BRAFV600E è presente nel 50% dei casi, seguita dai riarrangiamenti di RET (<20%) e di NTRK (~ 5%). Questi riarrangiamenti, spesso causati da radiazioni ionizzanti, sono più comuni nei bambini e sono associati a un fenotipo più aggressivo. La mutazione BRAFV600E si osserva nel 45% dei casi di ATC. Le mutazioni di RET si riscontrano nel MTC, nel 98% delle forme ereditarie e 50% delle sporadiche. Le tempistiche per i test molecolari dipendono dall’istologia e dai farmaci: per DTC e MTC si eseguono con la diagnosi di malattia radioiodio resistente/progressiva, per ATC già alla diagnosi. Per DTC radio-iodio resistente, lenvatinib (24 mg) è la prima linea di terapia. In seconda linea ci sono cabozantinib (60 mg) e selpercatinib (160 mg BID) per riarrangiamenti RET, già approvato dall’EMA per la prima linea. Entrectinib (600 mg) e larotrectinib (100 mg BID) sono indicati per riarrangiamenti NTRK. Dabrafenib (150 mg BID) e trametinib (2 mg) sono approvati per ATC con BRAFV600E (56% di risposte, PFS di 6,7 mesi, sopravvivenza media 14,5 mesi); lenvatinib 20 mg + pembrolizumab 200 mg è approvata per ATC senza mutazioni driver. Per MTC avanzato con mutazione RET, vandetanib (300 mg) e cabozantinib (140 mg) sono approvati in prima linea, selpercatinib (160 mg BID) in seconda linea, con approvazione EMA per la prima linea. Per MTC senza mutazione RET, cabozantinib (140 mg) è utilizzabile.
Linfoma di Hodgkin
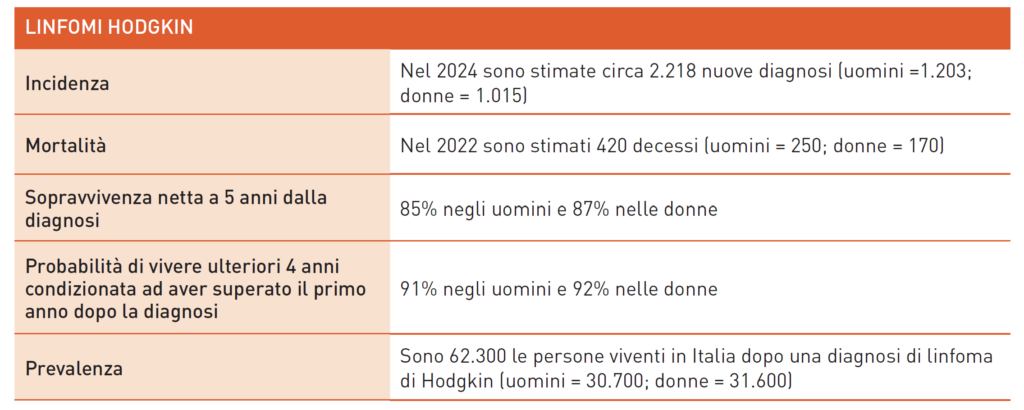
I linfomi di Hodgkin (LH) sono neoplasie ematologiche da proliferazione incontrollata di linfociti clonali, rappresentando il 15% delle sindromi linfoproliferative. Nei Paesi industrializzati, l’incidenza è di 3-4 casi per 100.000 abitanti, con maggiore prevalenza maschile. Colpiscono principalmente tra 20 e 30 anni, con un secondo picco a 70 anni, quando la malattia è più aggressiva. Fattori di rischio includono familiarità, infezioni da EBV e HIV. Non esistono programmi di prevenzione primaria e secondaria. Si manifesta con rigonfiamento linfonodale e sintomi aspecifici come febbre, perdita di peso e sudorazioni notturne. Lo stadio è determinato dal numero di linfonodi coinvolti e dall’estensione ad organi come polmoni, milza e ossa. Circa il 50% dei casi è avanzato. La diagnosi è confermata dall’esame istologico che identifica la Cellula di Reed-Sternberg. Il trattamento standard per LH classico include chemioterapia ABVD, a volte con radioterapia. Nei casi avanzati (stadio IV), si utilizza un anticorpo monoclonale (anti-CD30). Pazienti resistenti o recidivati possono essere trattati con terapie ad alte dosi e trapianto autologo. Grazie ai trattamenti, la sopravvivenza a 5 anni è circa 90%. Tuttavia, c’è un eccesso di mortalità a causa di eventi tardivi oncologici e cardiovascolari. In Italia, i sopravvissuti sono quasi 70.000, ma la sopravvivenza a 5 anni degli anziani è circa 50%. Le sfide future includono cure personalizzate per ridurre complicanze e migliorare l’approccio terapeutico negli anziani. La ricerca clinica è attiva con tecniche avanzate come FDG-PET e nuovi farmaci, tra cui anticorpi monoclonali e immunoterapia con checkpoint inibitori. Studi recenti mostrano miglioramento delle risposte con farmaci biologici, riducendo la progressione negli stadi avanzati. Si mira a ridurre l’uso di chemioterapici a favore di immunoterapia. Attenzione va data alla valutazione a lungo termine di efficacia e sicurezza, ancora ampiamente incompleta.
Linfoma Non Hodgkin (LNH)
I linfomi non Hodgkin (LNH) sono un gruppo di neoplasie del sistema immunitario, derivanti dai linfociti B, T o NK, con andamento indolente o aggressivo. Prevalentemente colpiscono persone di età medio-avanzata, sia uomini che donne. Dopo un aumento negli anni ’90, i casi si sono stabilizzati sotto i 20 su 100.000 abitanti. Sono tra i 10 tumori più comuni in Italia, rappresentando circa il 3% delle neoplasie. I LNH non sono ereditarie, ma fattori di rischio includono agenti infettivi, immunodepressione e sostanze tossiche. Non ci sono programmi di prevenzione e la diagnosi è spesso casuale. Dal 2000, la mortalità è diminuita grazie a terapie efficaci, specialmente per i LNH a cellule B, con un incremento della sopravvivenza. La prevalenza cresce dell’8% annuo. I LNH si trattano con chemioterapia, immunoterapia e a volte radioterapia. Sono tra le neoplasie più curabili, con una sopravvivenza a 5 anni del 67% per gli uomini e del 70% per le donne. Tuttavia, la sopravvivenza varia, oltre il 90% per alcuni linfomi indolenti, ma inferiore per quelli aggressivi come i linfomi a cellule T.
Le novità terapeutiche vedono un maggiore uso di immunoterapie mirate, sostituendo in alcuni casi la chemioterapia, come nella leucemia linfatica cronica. Le terapie cellulari, in particolare i CAR-T, sono una realtà in Italia. Questo trattamento modifica i linfociti T del paziente per eliminare le cellule neoplastiche. Inizialmente per linfoma B diffuso a grandi cellule, ora si usa precocemente anche per linfomi follicolari e mantellari recidivati/refrattari. Nuovi anticorpi, tra cui quelli bispecifici e immunoconiugati, mostrano efficacia contro vari linfomi e sono stati introdotti in Italia. Nuove classi di immunoterapie sono in sperimentazione clinica, ampliando le opzioni di cura.
Leucemie

Il termine “leucemia” deriva dal greco antico, unendo “leukos” (bianco) e “haima” (sangue). Le leucemie sono classificate in acute o croniche, in base alla progressione della malattia, e in linfatiche o mieloidi, secondo la cellula clonale di origine. Epidemiologicamente sono considerate un’entità unica, ma clinicamente e terapeuticamente è cruciale distinguere tra le forme. Le leucemie acute, come la Leucemia Linfoblastica Acuta (LLA) e la Leucemia Mieloide Acuta (LMA), hanno un decorso rapido e prognosi severa. Richiedono chemioterapia, immunoterapia e, in casi selezionati, trapianto di midollo osseo.
La LLA ha un picco tra i 2-5 anni e dopo i 65 anni. L’età d’insorgenza è cruciale per la prognosi, più favorevole nei bambini. Origina da un linfocita B nell’80% dei casi, o T nel restante 20%. Terapie innovative come la CAR-T e farmaci a bersaglio molecolare hanno migliorato la sopravvivenza, riducendo gli effetti collaterali. La LMA è la leucemia acuta più comune negli adulti, con 3-4 casi per 100.000 persone all’anno e un’età mediana di insorgenza di 68 anni. Recenti progressi terapeutici, inclusi farmaci mirati e chemioterapia standard, migliorano la sopravvivenza e il monitoraggio della malattia.
Le leucemie croniche, come la Leucemia Linfatica Cronica (LLC) e la Leucemia Mieloide Cronica (LMC), hanno un decorso lento, consentendo trattamenti che controllano la malattia. La LLC, comune negli adulti occidentali, è caratterizzata dall’accumulo di linfociti B anormali. Ha un’incidenza di circa 5 casi su 100.000 abitanti, prevalentemente nei maschi tra 60-70 anni. Nuovi farmaci mirati hanno migliorato la sopravvivenza e la qualità della vita. Sebbene classificata come leucemia per la sua diffusione, la LLC potrebbe essere più appropriata tra i linfomi non-Hodgkin.
La LMC, un tumore del sangue con proliferazione di cellule mieloidi e cromosoma Philadelphia, rappresenta il 15-20% delle leucemie e colpisce principalmente adulti. Le terapie con inibitori della tirosina chinasi (TKI) hanno rivoluzionato il trattamento, consentendo remissioni durature. Studi recenti mostrano che pazienti con risposte molecolari stabili possono sospendere gradualmente la terapia, mantenendo la remissione. Questo approccio, noto come “terapia-free remission,” è reso possibile dai test molecolari avanzati.
L’interpretazione dei dati epidemiologici è complessa poiché non riflette le specificità delle patologie. I dati su mortalità e sopravvivenza sono influenzati dall’aggressività delle LMA, offuscando l’efficacia delle terapie per le LLA nei bambini e il decorso meno aggressivo di LMC e LLC. È necessario un approccio che segua la classificazione clinica per rappresentare correttamente l’epidemiologia delle neoplasie ematologiche, evidenziando le differenze tra le patologie e valutando l’impatto delle nuove terapie.
Neoplasie neuroendocrine dell’apparato digerente (NET)
Le neoplasie neuroendocrine (NEN) sono considerate rare, con un’incidenza globale inferiore a 6 casi ogni 100.000 individui all’anno. Originano dalla degenerazione delle cellule del sistema neuroendocrino e possono insorgere ovunque nel corpo. Il termine NEN comprende forme ben differenziate (NET) e scarsamente differenziate (NEC). I NET sono più comuni nel tratto gastroenteropancreatico (GEP), specialmente nell’intestino tenue, mentre i NEC sono spesso polmonari, con il microcitoma polmonare che rappresenta circa il 90% dei NEC. La maggior parte delle NEN sono NET, in particolare quelle GEP, che rappresentano circa l’80% dei casi di NEN nel tratto GEP.
Le GEP NEN sono classificate secondo la classificazione OMS 2022 in base alla morfologia e al grado (G1, G2, G3) tramite il valore di Ki-67. I GEP NET sono ben differenziati e possono avere un grado basso, intermedio o alto. I GEP NEC sono scarsamente differenziati e sempre di alto grado. La prognosi per i pazienti con GEP NET è migliore rispetto a quelli con GEP NEC.
I GEP NET possono essere funzionanti o non funzionanti, a seconda dell’associazione con una sindrome clinica. I NET funzionanti sono rari e spesso si associano alla sindrome da carcinoide, specialmente se di origine ileale e con metastasi epatiche. I NET pancreatici possono essere legati a sindromi ereditarie come la MEN-1 o la sindrome di Von Hippel Lindau (VHL).
La diagnosi di GEP NEN può avvenire a seguito di sintomi specifici, sindromi associate, effetti massa, o incidentalmente in pazienti asintomatici. I “incidentalomi” pancreatici e gastroduodenali sono in aumento, grazie al miglioramento delle tecniche di imaging, ma possono riguardare anche forme avanzate.
Assicurarsi che la diagnosi riguardi una NEN pura con dati morfologici, immunoistochimici e di grading. È consigliata una revisione patologica centralizzata da un patologo specializzato in NEN, parte di un gruppo multidisciplinare dedicato. La stadiazione delle GEP NEN si effettua con imaging morfologico (TC, RM, Eco, EUS, endoscopia) e funzionale (PET/TC per recettori della somatostatina, PET/TC con FDG). È cruciale indirizzare ogni paziente con sospetta GEP NEN nel PDTA di un gruppo multidisciplinare dedicato. In Italia, centri accreditati ENETS e EURACAN sono riconosciuti come hub per i NET dalla Rete Italiana Tumori Rari. Questi centri devono avere un gruppo multispecialistico con oncologo, endocrinologo, gastroenterologo, chirurgo, medico nucleare, patologo, radiologo e radiologo interventista.
Per il trattamento di un paziente con GEP NEN, i fattori clinici sono discussi in un gruppo multidisciplinare. Fattori decisionali sono: morfologia, grado, presenza di sindrome clinica, espressione dei recettori della somatostatina, obiettivo della cura. Importanti, ma non cruciali, sono: PET-FDG, sintomi da effetto massa, sindrome ereditaria. Performance status e comorbidità restano fondamentali. Il trattamento di un GEP NET localizzato può essere chirurgico o endoscopico. I GEP NET avanzati sono valutati per chirurgia radicale, mentre i GEP NEC avanzati per chemioterapia. I GEP NET metastatici possono ricevere varie terapie sistemiche, inclusi analoghi della somatostatina, terapia radiorecettoriale, everolimus, sunitinib. Nei NET pancreatici si considera la chemioterapia con alchilanti o fluoropirimidine. I GEP NEC metastatici sono trattati con cisplatino o carboplatino + etoposide, mentre il regime FOLFIRINOX è usato per alcuni NEC gastrointestinali. Si raccomanda considerare studi clinici per GEP NEN avanzate, data l’assenza di sequenze terapeutiche validate.
Dal 2024, le NEN sono incluse ne “I numeri del cancro”. I dati AIRTUM più recenti su GEP NEN sono del 2016. Nel 2023, un gruppo AIRTUM/ItaNET ha analizzato 1.325 casi di GEP NEN dal 2012 al 2020. Le GEP NEN sono neoplasie rare con un’incidenza di 2,99 casi/100.000 abitanti/anno, circa lo 0,5% dei tumori adulti. In Italia, nel 2024 si attendono 1.738 nuovi casi. L’incidenza dei NET è di 2,16 casi/100.000 abitanti/anno, quella dei NEC è di 0,69 casi/100.000 abitanti/anno. L’incidenza è più alta negli uomini (3,16 casi) e tra gli anziani (oltre 8 casi/100.000 abitanti/anno). Le sedi comuni per NEC sono pancreas, colon e stomaco; per NET sono pancreas e intestino tenue.
Dr. De Lucia Francesco Paolo

FONTE: https://www.aiom.it/i-numeri-del-cancro-in-italia/